¿Qué es mol y un caso?
Por ejemplo: un mol es la cantidad total de cualquier cosa que tenga la misma cantidad total de partículas encontradas en 12.000 gramos de carbono-12. Ese número de partículas es el número de teléfono de Avogadro, que es más o menos 6.02×1023. Un mol de átomos de carbono es 6.02×1023 átomos de carbono.
- ¿Qué es el mol y un ejemplo?:
El mol es la unidad SI para medir cantidad de sustancia ; la cual contiene tantas partículas elementales como átomos de carbono hay en 0,012 kg de carbono-12. La entidad debe precisarse y puede ser un átomo, una molécula, un ion, un electrón, etc.
¿Cómo se calcula el mol ejemplos?
Por ejemplo: 1 mol de H 2 son 6,022.10 23 moléculas de H 2 y su masa es 2 gramos (2×1). 1 mol de N 2 son 6,022.10 23 moléculas de N 2 y su masa es 28 gramos (2×14). 1 mol de H 2 O bien son 6,022.10 23 moléculas de H 2 O bien y su masa es 18 gramos (2×1+16).
- ¿Cómo se calcula el mol?:
O sea, el número de teléfono de moles se calcula dividiendo la masa a caballo entre la masa molar de las sustancia.
¿Qué hay en 1 mol?
El mol es una mesura de cantidad usada por los científicos. Un mol equivale a 6,022×10 23 unidades. Un mol es una unidad esencial porque en la tabla periódica un mol de una sustancia es igualito a su masa atómica en gramos.
- ¿Qué hay en un mol?:
Un mol equivale a 6,022×10 23 unidades. Un mol es una unidad esencial porque en la tabla periódica un mol de una substancia es igual a su masa atómica en gramos. Un mol es un número de teléfono enorme porque si existe un mol de granitos de arena, es más o bien menos el número de teléfono de granitos de arena en la Tierra, según XKCD whatif.
¿Dónde se puede utilizar el mol?
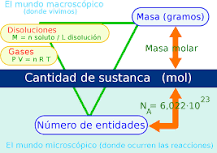
El mol sirve como puente para conocer el número de partículas que hay en una sola determinada cantidad de masa; de esta forma, es posible conseguir la masa molar de las substancias.
¿Qué es mol explicacion?
El mol se define de la siguiente forma: el mol, símbolo mol, es la unidad SI de cantidad total de sustancia de una entidad elemental, la como puede ser un átomo, molécula, ion, electrón, o cualquier otra partícula o bien un conjunto específico de semejantes partículas; su magnitud se establece a través de la fijación del valor numérico de
¿Cómo se calcula mol fórmula?
Mol (n)= masa(g)/masa molar (g/ mol )
MM del alcohol etílico (C2H5OH) C = 12 x2 = 24 H = 1 x 6 = 6 O bien = 16 x 1 =16 46 g/ mol ‘a2 Aplicar la fórmula de molaridad.
MM del alcohol etílico (C2H5OH) C = 12 x2 = 24 H = 1 x 6 = 6 O bien = 16 x 1 =16 46 g/ mol ‘a2 Aplicar la fórmula de molaridad.
¿Cuántos átomos hay en 1 mol?
1 mol de átomos contiene 6,02 · 1023 átomos. 1 mol de moléculas contiene 6,02 · 1023 moléculas.
¿Cuántos UMA son 1 mol?
Un mol es la cantidad total de sustancia que contiene el número de teléfono de Avogadro de partículas (átomos, moléculas, iones, electrones, etc). El número de teléfono de Avogadro (NA) vale 6’023 · 1023 partículas.
¿Dónde se emplea mol?
El término de mol
se utiliza mol, que es reconocido por el Sistema Internacional de Unidades como la ideal para medir la cantidad total de sustancia. Por consiguiente, 1 mol de átomos de sodio, 1 mol de moléculas de agua, etc.
se utiliza mol, que es reconocido por el Sistema Internacional de Unidades como la ideal para medir la cantidad total de sustancia. Por consiguiente, 1 mol de átomos de sodio, 1 mol de moléculas de agua, etc.
¿Qué debe ver el mol en la vida rutinaria?
Una forma de servirse un mol de moléculas de agua es pesar la masa de la sustancia que contiene un número de teléfono de Avogadro de partículas. Una balanza. Recipientes de vidrio o bien plástico trasparentes (por ejemplo, frasquitos de mermelada). Clavos de fierro (más o bien menos 100 g).