¿Cuál es la estructura molecular del cloruro de sodio?
NaCl Cloruro de sodio / Fórmula Cloruro de sodio: fórmula y propiedades
El cloruro de sodio, con fórmula NaCl, es un compuesto iónico. En algunas otras vocablos, los átomos que lo constituyen se enlazan a través de la transferencia de electrones. En concreto, el sodio (Na) solo tiene un electrón en su capa más externa y lo pierde con facilidad.
El cloruro de sodio, con fórmula NaCl, es un compuesto iónico. En algunas otras vocablos, los átomos que lo constituyen se enlazan a través de la transferencia de electrones. En concreto, el sodio (Na) solo tiene un electrón en su capa más externa y lo pierde con facilidad.
¿Cómo representar el cloruro de sodio?
Cloruro de sodio ( NaCl )
- ¿Cómo se escenifica el cloruro de sodio?:
El cloruro de sodio ( NaCl ), comúnmente conocido como sal, es uno de los minerales más copiosas de la Tierra y un nutriente esencial como para muchísimos animales y plantas. Se encuentra de constituye natural en el agua de mar y en formaciones rocosas subterráneas.
- ¿Cómo se puede representar el cloruro de sodio?:
El cloruro de sodio, con fórmula NaCl, es un compuesto iónico.
¿Qué género de fuerza molecular presenta el cloruro de sodio NaCl )?
Dentro del cloruro de sodio compacto, NaCl (s), se da la interacción ion-ion entre los iones sodio (Na+) y cloruro (Cl-). Cuando a intensidad de la fuerza sigue la interacción ion-dipolo, la cual se da en soluciones acuosas de cloruro de sodio.
¿Cuántas moléculas tiene el cloruro de sodio?
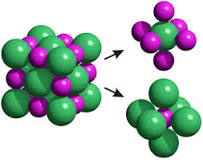
Es muy cómodo denominar molécula a una agrupación de un sodio y un cloro solo pues la fórmula del compuesto es NaCl y es fácil proferir que 1 mol de cloruro de sodio son 6,022·10^23 moléculas de cloruro de sodio. Sí, simple y cómodo.
- ¿Qué molécula tiene el cloruro de sodio?:
Cloruro de sodio: fórmula y propiedades
El cloruro de sodio, con fórmula NaCl, es un compuesto iónico. En otras vocablos, los átomos que lo constituyen se enlazan a través de la trasferencia de electrones. En concreto, el sodio (Na) sólo tiene un electrón en su capa más externa y lo pierde con facilidad.
¿Qué estructura presenta el cloruro de sodio?
La estructura molecular del cloruro de sodio es NaCl, es decir la fusión del sodio (Na) con el cloro (Cl) los dos militantes muy esenciales de la tabla periódica.
¿Qué tipo de molécula es NaCl?
Fórmula química del cloruro de sodio o cloruro sódico (sal de mesa).
- ¿Qué tipo de molécula es el NaCl?:
El cloruro de sodio, con fórmula NaCl, es un compuesto iónico. En algunas otras vocablos, los átomos que lo forman se enlazan a través de la trasferencia de electrones. En concreto, el sodio (Na) sólo tiene un electrón en su capa más externa y lo está perdiendo con sencillez.
¿Qué estructura y propiedades tiene el cloruro de sodio?
El cloruro sódico, más notorio como sal muy habitual, es un compuesto conformado por sodio y cloro. Su fórmula es NaCl.Su estado físico en temperatura entorno es de un compacto blanco cristalino.
Cloruro de sodio.
Cloruro de sodio.
| General | |
|---|---|
| Punto de ebullición | 1738 K (1465 °C) |
| Densidad | 2,2 ×10 3 kg/m 3 |
| Estructura cristalina | f.c.c. |
| Solubilidad | 35,9 g en 100g de agua |
¿Qué elementos componen el cloruro de sodio?
Sal Cloruro de sodio / Clasificación En química, una sal es un compuesto químico formado por cationes enlazados a aniones a través de un link iónico. Son el producto habitual de una reacción química a caballo entre una base y un ácido, donde la base confiere el catión y el ácido el anión. Wikipedia
¿Cómo se escenifica el NaCl usando la estructura de Lewis sal?
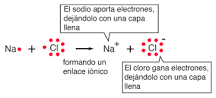
El enlace iónico del NaCl se puede visualizar en términos de diagramas de Lewis. En cuanto el sodio está perdiendo un electrón como para constituir Na +, su tamaño efectivo se reduce a la mitad. En cuanto el cloro está ganando un electrón como para producir la estructura de octeto Cl –, su tamaño aumenta a prácticamente el doble (Shipman, et al).
¿Qué es Na+ y Cl?
El cloruro de sodio (NaCl) es de hecho la sujeción de un ion Na + y de un ion Cl – que se atraen mutuamente debajo del efecto de la atracción electrostática.
¿Cómo se forma el cloruro de sodio?
El cloruro de sodio, se consigue eminentemente del agua de mar, la cual es sometida a diferentes procesos de evaporación hasta provocar la concentración de sales presente en exactamente la misma, principalmente del cloruro de sodio (componente mayoritario), hasta conseguir la capacitación de las salmueras (solucion con alta
¿Qué género de fuerza tiene el NaCl?
Dentro del cloruro de sodio sólido, NaCl (s), se da la interacción ion-ion a caballo entre los iones sodio (Na+) y cloruro (Cl-). En cuanto a intensidad de la fuerza sigue la interacción ion-dipolo, la cual se da en soluciones aguadas de cloruro de sodio.
¿Qué tipo de sujeción molecular consiente la formación de NaCl?
La fuerte atracción electrostática entre cationes y aniones adyacentes se conoce como enlace iónico. El ejemplo más muy habitual de un compuesto iónico es el cloruro de sodio, NaCl, mejor notorio como sal de mesa. A diferencia de los compuestos covalentes, no existe algo como una molécula de un compuesto iónico.
¿Qué género de fuerza hay que vencer como para derretir el cloruro de sodio?
32. – Para derretir el NaCl hay que vencer obligas electrostáticas de un link iónico. Como para fundir el hierro hay que romper un link metálico que brota de la atracción a caballo entre una nube de electrones de valencia deslocalizados y los cationes de hierro que ocupan los nudos de la red cristalina.
¿Cuántas moléculas tiene Na?
El número 6,02 · 1023, se llama número de teléfono de Avogadro, NA. En cuanto al número de partículas que contiene, el mol es un concepto parecida al de docena: 1 docena contiene 12 partículas.
- ¿Cuántas moléculas tiene un compuesto?:
Generalmente, un mol de cualquier sustancia contiene 6,022 x 10 23 moléculas o átomos de felicidad substancia. Así pues En un mol de agua (H2O) hay 6,022 × 10 23 moléculas de H2O, o lo cual es precisamente lo mismo, 2 × 6,022 × 10 23 átomos de hidrógeno y 6,022 × 10 23 átomos de oxígeno.
¿Cuántas moléculas de cloruro de sodio hay en 25 g?
x= [( 25 )(6.023^23)] / 36.45 = 4.131×10^23 moléculas.


















