¿Cuáles son las características de los gases ideales?
Un gas ideal es un gas en el cual las partículas (a) no se atraen ni se repelen mutuamente y (b) no ocupan espacio (no poseen volumen). Ningún gas es realmente ideal, pero la ley de los gases ideales sí confiere una buena aproximación del comportamiento real de los gases bajo muchas condiciones.
¿Qué dice la ley de los gases ideales?
LEY DE LOS GASES IDEALES. Si comprimimos un gas, manteniendo constante su temperatura, veremos que la presión aumenta al reducir el volumen. Análogamente, si estamos haciendo que se expansione un gas a temperatura constante, su presión reduce al acrecentar el volumen.
¿Qué es la ley de gases ideales y para qué sirve?
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales sin atracción ni repulsión a caballo entre ellas y cuyos colisiones son de manera perfecta flexibles (conservación por el momento y energía cinética).
¿Cuáles son las 4 propiedades de los gases?
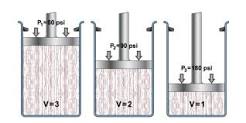
Los gases pueden comprimirse al aplicarles presión.
Los gases presentan las próximas propiedades :
- No poseen volumen propio.
- No tienen constituye distintiva.
- Pueden dilatarse y contraerse.
- Tienen gran fluidez.
- Tienen alta difusion.
- Solubilidad.
- ¿Cuáles son las propiedades químicas de los gases?:
Las propiedades de los gases ideales son: Están formados por un número de teléfono determinado de moléculas. No hay obligas de atracción o bien de repulsión entre sus moléculas. No hay colapso alguno entre las moléculas, ni cambios en su natura fisica (esto es, cambios de fase).
- ¿Cuáles son las principales propiedades de los gases?:
Características Esenciales de los Gases
Ocupan todo el volumen del recipiente que los contiene. Son Miscibles y constituyen mezclas. Su comportamiento se define por la temperatura y la presión. Las moléculas de los gases ejercitan presión sobre las paredes del recipiente que los contiene.
¿Cuáles son las 4 leyes de los gases?
Véase asimismo
- Ley de Avogadro.
- Ley de los gases ideales.
- Ley de Boyle-Mariotte.
- Ley de Gay-Lussac.
- Ley de Hables.
- ¿Cuáles son las 4 variables de los gases?:
Introducción a las actividades
El estado de un gas se caracteriza por cuatro alterables: presión (P), volumen (V), temperatura (T) y cantidad total del gas (expresada en moles). Las leyes empíricas estudiadas relacionan dos de estas cambiantes, mientras que las otras dos continúan constantes.
¿Qué propiedades poseen los gases ideales?
La ley de los gases ideales (PV = nRT) correlaciona las propiedades macroscópicas de los gases ideales. Un gas ideal es un gas en el que las partículas (a) no se atraen ni se repelen mutuamente y (b) no ocupan espacio (no tienen volumen).
¿Cuáles son las propiedades físicas que intervienen en la ecuación de los gases ideales?
La presión, P, la temperatura, T, y el volumen, V, de un gas ideal, están relacionados por una fácil fórmula denominada la ley del gas ideal.
¿Qué características tiene el gas ideal?
Se define un gas ideal como aquél para el que PV/nT es constante a todas las presiones. En este caso, la presión, el volumen y la temperatura estan relacionados por PV=nRT (Ley de los gases ideales).
¿Qué características están haciendo distintos a los gases ideales de los gases reales?
Las moléculas chocan entre sí de forma inelástica.
Un gas ideal es un gas hipotético, mientras tanto que el gas real existe en la naturaleza que nos circunda. El gas ideal obedece las leyes de los gases y, en cambio, los gases reales obedecen las leyes de los gases en condiciones de baja presión y elevada temperatura.
Un gas ideal es un gas hipotético, mientras tanto que el gas real existe en la naturaleza que nos circunda. El gas ideal obedece las leyes de los gases y, en cambio, los gases reales obedecen las leyes de los gases en condiciones de baja presión y elevada temperatura.
¿Qué es una característica de los gases?
Los gases: No poseen forma ni volumen fijos. En ellos es muy característica la gran fluctuación de volumen que experimentan al cambiar las condiciones de temperatura y presión.
¿Cómo se clasifican los gases y cuáles son sus características?
Los gases se pueden clasificar primordialmente desde dos puntos de vista: químico y físico. A partir de un punto de vista químico se clasifican en: Inflamables: butano, metano, hidrógeno, propeno. No inflamables: N 2, O bien 2, Helio, CO, Argón.
¿Quién estipula la ley de los gases ideales?
Robert Boyle, el químico e inventor irlandés que formuló la conocida ley de los gases que lleva su nombre. Boyle fue un vanguardista de la experimentación en el ámbito de la química, en particular en lo relativo a las propiedades de los gases.
¿Cuántas son las leyes de los gases ideales?
La ecuación del gas ideal se basa condensa la ley de Boyle, la de Gay-Lussac, la de Hables y la ley de Avogadro.
¿Qué son las leyes de los gases y para qué sirve?
La ley experimental de los gases es una ley que combina la ley de Boyle-Mariotte, la ley de Charles y la ley de Gay-Lussac. Estas mismas leyes se refieren a cada una de las cambiantes que son presión, volumen y temperatura absoluta.
¿Dónde se emplean los gases ideales?
El modelo de gas ideal también ha sido usado para modelar el comportamiento de electrones en un metal (en el Modelo de Drude y en el modelo de electrón libre), y es uno de los tipos más esenciales utilizados en la mecánica estadística.
¿Cuándo se usa la ecuación de los gases ideales?
Aunque en la naturaleza no existe un gas ideal, las discrepancias dentro del comportamiento de los gases reales en márgenes razonables de temperatura y presión no alteran substancialmente los cálculos. En consecuencia, podemos utilizar con seguridad la ecuación del gas ideal para resolver muchos inconvenientes de gases.
¿Qué establece la ley de Hables de los gases ideales?
En ésta ley, Charles dice que a una presión incesante, al acrecentar la temperatura, el volumen del gas aumenta y al reducir la temperatura el volumen del gas disminuye. Ésto se debe a que ‘temperatura’ significa movimiento de las partículas.
¿Qué son gases y cuáles son sus propiedades?

Los gases ocupan absolutamente el volumen del recipiente que los contiene. Los gases no poseen constituye definida, adoptando la de los recipientes que las contiene. Están pudiendo comprimirse fácilmente, tenido que a que existen enormes espacios vacíos a caballo entre unas moléculas y algunas otras.
¿Cómo se relacionan las cuatro propiedades de los gases?
La difusión es el proceso judicial en el que el gas se mezcla con otro tenido que al movimiento de sus moléculas. La compresión en cuanto el volumen de un gas disminuye tenido que a la presión que se ejercita acercando a las moléculas entre sí. La resistencia es en cuanto los gases se oponen al movimiento de los cuerpos por el aire.


















