¿Qué es un choque ineficaz y que uno eficaz?
Si el choque cumple con estos requisitos básicos es eficaz, si nos los cumple es ineficaz, esto es, un choque eficaz es aquél que produzca la suficiente energía como para romper links y da lugar a un sitio complejo llamadocomplejo activado y más tarde a la formacion de productos, mientras que un choque ineficaz es aquél que
- ¿Qué es un choque ineficaz?:
En cuanto la molécula del reactivo no tiene ni la energía suficiente, ni la orientación adecuada (ángulo) la colisión o choque resultante es ineficaz (b).
¿Cómo es el choque entre las moléculas efectivo o no?
Las moléculas de los reactivos poseen que chocar entre sí. Estos colisiones deben de producirse con energía suficiente de tal modo que se puedan romper y formar links químicos. En el choque debe haber una orientación adecuada a fin de que los enlaces que se poseen que romper y constituir estén a una distancia y situación factible.
¿Qué dice la teoría de las colisiones?
La teoría de colisiones explica por qué la mayoría de las velocidades de reacción aumentan a la medida que aumentan las concentraciones. Al acrecentar la concentración de cualquier sustancia que reaccione, aumentan las prestaciones de colisión entre las moléculas por el hecho de que hay más moléculas por unidad de volumen.
¿Qué es lo que significa que un choque sea eficaz?
Las colisiones exitosas tienen energía suficiente (energía de activación), al momento del impacto, como para romper los enlaces existentes y constituir nuevos enlaces, resultando en los productos de la reacción.
¿Qué es un choque eficaz y qué produce?
(effective collision) Quím. Colisión entre dos moléculas o especies con energía suficiente a fin de que pueda generarse una reacción química entre ellas.
¿Cuáles son las teorias usadas como para justificar diferencias velocidades reacciones?
Hay dos grandes teorías que procuran explicar las cinéticas de las reacciones químicas: la teoría de las colisiones y la teoría del estado de transición. La teoría de las colisiones se emplea como para predecir la cinética de las reacciones químicas, específicamente como para los gases.
¿Que son y qué ocurre con las colisiones?

En cuanto dos o más cuerpos se aproximan entre sí, entre los mismos actúan fuerzas internas que están haciendo que su momento lineal y su energía varíen, produciéndose un intercambio entre los mismos de ambas magnitudes. En este mismo caso se dice que entre los cuerpos se ha infligido una colisión o choque.
¿Cuándo se habla de que un choque es ineficaz?
Un choque inelástico es en el que hay una pérdida de energía cinética. Mientras que en este mismo género de choques se perpetúa el instante del sistema, la energía cinética no.
¿Qué es una colisión ineficaz?
Un choque que no produce reacción química se denomina Choque No Flexible o Inútil.
¿Qué son las colisiones y cómo es que se clasifican?
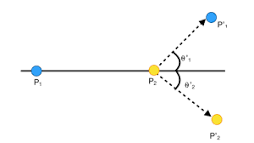
Colisión con perfección elástica: Es aquella en la que no se disipa energía cinética y esta se conserva. Colisión inelástica: es aquella en la que se disipa parte de la energía cinética. Colisión completamente inelástica: Es aquélla en la que se disipa el máximo de energía.
¿En qué momento se produce un choque efectivo las moléculas?
A fin de que una colisión sea triunfante, las moléculas reactantes deben colisionar con suficiente energía como para superar la barrera de la energía de activación, y tener una orientación conveniente como para formar nuevos links en los productos.
¿Cómo son los colisiones de las moléculas?
Los colisiones de las moléculas son elásticos, no hay pérdida ni ganancia de energía cinética, aunque puede existir trasferencia de energía entre las moléculas que colisionan.
¿Qué es un choque efectivo?
Como decíamos en la introducción, en ésta teoría se estima que una reacción elemental se produce en cuanto dos especies químicas chocan con la suficiente energía y con la orientación apropiada ( choque efectivo ).
¿Qué pasa si dos moléculas chocan?
Cuando las especies de reactivos colisionan con la orientación correcta y la energía conveniente, se combinan para constituir una especie inestable llamada sofisticado activado o estado de transición.
¿Que son y que indican la teoría de las colisiones y la teoría del sofisticado activado?
Esta teoría postula que los reactivos tienen que chocar, con una orientación adecuada y energía suficiente. En cuanto el choque es eficaz se debilitan unos enlaces y se empiezan a formar otros. La ‘especie característica o punto intermedio’ adonde esto ocurre lleva por nombre estado de transición o complejo activado.
¿Qué coeficientes afectan la teoría de las colisiones?
Los cuatro factores que influyen más de forma significativa en la velocidad una reacción química segun la teoría de las colisiones son: la concentración de los reactivos, el estado físico y el grado de división de los reactivos, la temperatura y los catalizadores.
¿Cuál es el efecto de la temperatura en la teoría de las colisiones?
La Temperatura afecta a la velocidad de la reacción. Una mayor temperatura implica una mayor energía cinética de las moléculas, por lo cual aumentará la probabilidad de que las colisiones sean productivas.