¿Cuál es el género de enlace de NaCl?
El Cloruro de Sodio, NaCl
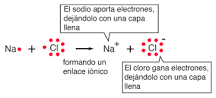
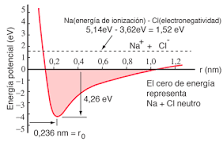
El caso clásico de enlace iónico, la molécula de cloruro de sodio, se forma por la ionización de los átomos de sodio y cloro, y la atracción de los iones resultantes.
- ¿Cuál es el género de enlace de HCl?:
Enlace Covalente en el Cloruro de Hidrógeno, HCl
Cuando un átomo de H se una a un átomo de Cl, se genera un enlace covalente polar simple: En el cloruro de hidrógeno se comparten un electrón del átomo de H y un electrón del átomo de Cl, lo como da al H y al Cl la configuración estable de gas hidalgo.
¿Cómo representar NaCl?
¿Cuál es la estructura de Lewis de sodio?
¿Qué es la estructura de Lewis y ejemplos?

La estructura de Lewis es una forma de enseñar los electrones de la capa exterior de un átomo. Esta representación consiste en poner el símbolo del elemento de la tabla periódica, y marcar a su alrededor puntos o asteriscos para indicar los electrones externos que tienen.
¿Cuál es la estructura de cloruro de sodio?
- ¿Cuál es la estructura de Lewis del cloruro de sodio?:
Estructura de Lewis del NaCl Cloruro de SodioSe puede apreciar en la imagen que el átomo de sodio cede el electrón al átomo de cloro, luego entonces el cloro puede cumplir con la regla del octeto. El género de enlace del cloruro de sodio es enlace ionico.
¿Cuál es el tipo de enlace de cloruro de sodio?
¿Cómo se estructura la estructura de Lewis?
- ¿Cómo se representa el NaCl empleando la estructura de Lewis?:
El enlace iónico del NaCl se puede visualizar en términos de diagramas de Lewis. En cuanto el sodio está perdiendo un electrón como para formar Na +, su tamaño efectivo se reduce a la mitad. En cuanto el cloro gana un electrón para infligir la estructura de octeto Cl –, su tamaño aumenta a casi el doble (Shipman, et al).
¿Qué género de estructura tiene el NaCl?
¿Qué género de enlace es NaCl y porqué?
¿Qué tipo de enlace es NaCl fácil doble o bien triple?
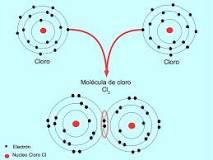
Link covalente simple
Un cloro puede conjuntarse con otro cloro como para formar la molécula de cloro Cl 2 que es mucho más estable que los cloros por separados. Entre dos átomos de cloro se comparten un par de electrones constituyendo un enlace fácil.
¿Cómo se constituye el enlace NaCl?
El caso clásico de enlace iónico, la molécula de cloruro de sodio, se constituye por la ionización de los átomos de sodio y cloro, y la atracción de los iones resultantes.