¿Qué produce el descenso crioscópico?
El descenso crioscópico se emplea en la industria como para determinar masas moleculares de productos químicos que se fabrican, al igualito que se hace a nivel de laboratorio.
¿Cómo se expresa el descenso crioscópico?
la actividad se expresa en mol/kg y se obtiene multiplicando la molalidad por el factor de actividad.
¿Cómo se comporta la Crioscopia al disminuir la concentración?
Ésta disolución es demasiado concentrada como para estar en equilibrio con el hielo, se derretirá más hielo, reducirá la concentración de la disolución que entonces disuelve más sal. Como consecuencia de éstos procesos la temperatura de todo el sistema disminuye hasta alcanzar temperaturas cercanas a -21 °C.
¿Qué aplicaciones tiene la disminución del punto de congelación?
Una grato aplicación de la depresión del punto de congelación está en la fabricación de helados caseros. La mezcla de gélido se está poniendo dentro de un recipiente de metal que está rodeado por hielo picado. Acto seguido, se pone sal en el hielo como para disminuir su punto de fusión.
¿Cómo influye el género de soluto en el descenso crioscópico?
En verdad, a medida que el punto de ebullición de un solvente aumenta, su punto de congelación reduce. Un caso de esto sería la adición de sal a una acera congelada. El soluto (sal) disminuye el punto de congelación del hielo, lo que lleva a cabo que el hielo se derrita a una menor de edad temperatura.
¿Que nos indica la incesante Crioscópica de un disolvente?
es la incesante crioscópica, siendo Tf la temperatura de congelación del disolvente puro y lf su calor latente de fusión por unidad de masa. La incesante crioscópica kc es una magnitud caracteristica del disolvente y no depende de la naturaleza del soluto. Para el agua destilada, kc = 1.86 K kg mol-1.
¿Cómo se puede bajar el punto de congelación del agua?
El punto de congelación del agua mera es de 0°C, pero ese punto de fusión puede llegar a ser disminuido por la adición de un disolvente tal y como una sal.
¿Que se comprende por descenso crioscópico?
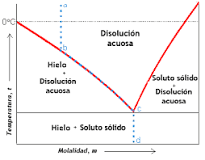
El Descenso crioscópico es la disminución de la temperatura del punto de congelación que está experimentando una solucion con respecto a la del solucione puro.
¿Qué escenifica la constante Crioscópica?
La incesante crioscópica kc es una magnitud caracteristica del disolvente y no depende de la naturaleza del soluto. Como para el agua destilada, kc = 1.86 K kg mol-1. la masa molecular del soluto.
¿Cómo calcular la incesante del descenso del punto de congelación?
De la disminución del punto de congelación, así determinado, se puede calcular la masa molar de la sustancia estudiada a través de la próxima expresión: Con los valores del ejemplo del ensayo (m 1 = 0,63 g; m 2 = 11,56 g; ‘4T = |’4T A1 | = 1,59 K; K k = 1853 K*g/mol ) se consigue para el glicol etilénico: M 1 = 63,51 g/mol.
¿Qué ocurre con el descenso crioscópico?
El Descenso crioscópico es la disminución de la temperatura del punto de congelación que experimenta una solución respecto a la del solucione puro. Todas y cada una las soluciones poseen una temperatura de congelación muy inferior al solvente puro.
¿Qué aplicación tiene el descenso del punto de congelación?

En el campo científico, el descenso del punto de congelación nos sirve para determinar las masas moleculares de solutos.
¿Cuáles son las aplicaciones de las propiedades coligativas?
Las propiedades coligativas poseen una gran importancia tanto en nuestra propia vida rutinaria, como en procesos judiciales industriales, ya que su conocimiento y aplicación adecuada nos consiente: Alejar componentes de una solucion mediante destilación fraccionada. Calcular masas molares de solutos ignotos.
¿Qué aplicaciones tiene el descenso crioscópico en la vida cotidiana?
El descenso crioscópico puede llegar a ser usado par determinar la actividad de un soluto en solución o su grado de disociación dentro de un solucione dado. Es merced al descenso crioscópico que puede utilizarse sal muy habitual como para derretir nieve, hielo o escarcha sencillamente espolvoreandolo.
¿Cómo se afecta el punto de congelación de en las soluciones?
La solucion tiene un punto de congelación más bajo que el del solucione puro. Cuando una substancia comienza a congelarse, las moléculas se ralentizan debido a la disminución de la temperatura y las fuerzas intermoleculares empiezan a jalar el control.


















