¿Cuánto es la masa molar del HNO3?
22 Ácido nítrico
CAS 13 [7697-37-2] Fórmula y masa molecular 13 HNO3 13 63,01 Especificación 13 Contiene como mínimo 63,0% (p/p).
CAS 13 [7697-37-2] Fórmula y masa molecular 13 HNO3 13 63,01 Especificación 13 Contiene como mínimo 63,0% (p/p).
- ¿Cuánto es la masa molar del NaOH?:
Solución: El peso fórmula del NaOH es 40.0; por consiguiente hay 40.0 g dentro de un mol.
- ¿Cuánto es la masa molar de h2s?:
Ácido sulfhídrico Propiedades físicas Apariencia gas incoloro Masa molar 34,1 g/ mol Punto de fusión 187 K («1286 °C)
¿Cuántos átomos tiene el HNO3?
Estructura del ácido Nítrico, HNO3
Cada uno de ellos de los átomos de oxígeno tiene 6 electrones exteriores, 1 átomo de ázoe tiene 5 electrones externos y 1 átomo de hidrógeno tienen 1 electrón externo, en consecuencia, hay un número total de 24 electrones exteriores.
Cada uno de ellos de los átomos de oxígeno tiene 6 electrones exteriores, 1 átomo de ázoe tiene 5 electrones externos y 1 átomo de hidrógeno tienen 1 electrón externo, en consecuencia, hay un número total de 24 electrones exteriores.
¿Cómo es que sacar el porcentaje de HNO3?
La composición porcentual se halla mediante la fórmula:
- %E= (masa del elemento/ masa total) * 100.
- HNO 83= 63 g/mol.
- %H= 1.59%
- %N= 22.22%
- %O bien= 76.19%
- Nota: Las composiciones porcentuales deben sumar 100%.
¿Cómo es que se calcula la masa molecular de una molécula?
Se calcula a través de la suma de las masas atómicas de los átomos que constituyen la molécula. Puede expresarse en uma o en gramos. En cuanto se expresa en uma nos referimos a la masa de una molécula, mientras que si se realiza en gramos la masa molecular se refiere al NA de moléculas.
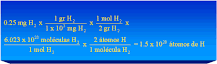
¿Cuántas moléculas hay en un mol de ácido nítrico?
n = 1 mol = 6,022 · 1023 partículas m = = Si Masa molecular = 63 u ¿Cuántos moles de ácido nítrico hay dentro del recipiente?
¿Cómo es que se forma el ácido nítrico?
El dióxido de ázoe y el tetróxido de dinitrógeno (N2O4), dímero del dióxido de nitrógeno, reacciona exotérmicamente con el agua desionizada para entregar lugar a ácido nítrico y óxido nítrico.
¿Cuál es el mol de HNO3?
63.02 g/mol FORMULA: HNO3 PESO MOLECULAR: 63.02 g/ mol.
¿Qué significa la fórmula HNO3?
El ácido nítrico es un líquido incoloro a amarillo con un propio fragancia irritante.
¿Cuánto es el peso molecular de HNO3?
FORMULA: HNO3 PESO MOLECULAR: 63.02 g/mol.
¿Cuántos moles hay en HNO3?
Contestación. entonces HNO3 tiene una masa de 63 y a esto equivale una mol.
¿Cómo saber el peso molecular de un ácido?
Calcular es peso molecular
- La molécula contiene dos átomos. El subíndice señala el número de teléfono de átomos presentes.
- Como para calcular el peso molecular, verifica el peso atómico del elemento.
- El peso atómico como para el factor hidrogeno es 1 g/mol.
- Multiplica el peso atómico por el número de teléfono de átomos presentes.
¿Cómo es que determinar la masa molar de HNO3?
FORMULA: HNO3 PESO MOLECULAR: 63.02 g/ mol.
¿Cuánto pesa un litro de ácido nítrico?
60% Densidad: 1.4 kg / l.
¿Cómo es que se calcula el peso molecular?
Como para calcular el peso molecular es necesario saber el número de moléculas presentes. La MASA MOLECULAR (o bien PESO FÓRMULA) es un número de teléfono que indica cuántas veces la masa de una molécula de una sustancia es mayor que la unidad de masa molecular y sus elementos, se calcula sumando todas las masas atómicas de dicho elemento.
¿Cómo calcular la masa molar del ácido nitroso?
47,013 g/mol Ácido nitroso / Masa molar
¿Cómo es que se realiza el cálculo de la masa molar?
En un compuesto la masa molar es igual a la suma del peso o bien masa atómica de sus átomos multiplicado por la cantidad total de moléculas. Como para entregar acatamiento a la ley de la manutención de la asignatura, el cálculo se realiza en una ecuación química balanceada.
¿Cómo obtener la masa molar y molecular?
Masa m = n mol (M g / 1 mol ) = n M m g. O sea, la masa se calcula multiplicando el número de teléfono de moles por la masa molar de la substancia.
¿Qué contiene el ácido nítrico?
El ácido nítrico se puede obtener llevando a cabo reaccionar dióxido de ázoe con agua. Como para fines comerciales, el método de producción básico es el denominado proceso Ostwald. Ésta es la oxidación catalítica de amoníaco a óxido nítrico, que, usando torres de succión especiales, produce ácido HNO 3 concentrado.